Sommario per questo articolo:
1. Sviluppo di amminoacidi
2. Proprietà strutturali
3. Composizione chimica
4.Classificazione
5. Sintesi
6. Proprietà fisico-chimiche
7. Tossicità
8. Attività antimicrobica
9. Proprietà reologiche
10. Applicazioni nell'industria cosmetica
11. Applicazioni nei cosmetici di tutti i giorni
Tensioattivi amminoacidici (AAS)sono una classe di tensioattivi formati dalla combinazione di gruppi idrofobici con uno o più amminoacidi.In questo caso gli Aminoacidi possono essere sintetici o derivati da idrolizzati proteici o simili fonti rinnovabili.Questo documento copre i dettagli della maggior parte delle vie sintetiche disponibili per AAS e l'effetto di diverse vie sulle proprietà fisico-chimiche dei prodotti finali, tra cui solubilità, stabilità della dispersione, tossicità e biodegradabilità.Essendo una classe di tensioattivi sempre più richiesta, la versatilità degli AAS grazie alla loro struttura variabile offre un gran numero di opportunità commerciali.
Dato che i tensioattivi sono ampiamente utilizzati in detergenti, emulsionanti, inibitori di corrosione, recupero di olio terziario e prodotti farmaceutici, i ricercatori non hanno mai smesso di prestare attenzione ai tensioattivi.
I tensioattivi sono i prodotti chimici più rappresentativi che vengono consumati quotidianamente in grandi quantità in tutto il mondo e hanno avuto un impatto negativo sull'ambiente acquatico.Gli studi hanno dimostrato che l'uso diffuso dei tensioattivi tradizionali può avere un impatto negativo sull'ambiente.
Oggi, la non tossicità, la biodegradabilità e la biocompatibilità sono importanti per i consumatori quasi quanto l'utilità e le prestazioni dei tensioattivi.
I biosurfattanti sono tensioattivi sostenibili rispettosi dell'ambiente che sono naturalmente sintetizzati da microrganismi come batteri, funghi e lieviti o secreti a livello extracellulare.Pertanto, i biosurfattanti possono anche essere preparati mediante progettazione molecolare per imitare le strutture anfifiliche naturali, come fosfolipidi, glicosidi alchilici e amminoacidi acilici.
Tensioattivi amminoacidici (AAS)sono uno dei tensioattivi tipici, solitamente prodotti da materie prime di origine animale o agricola.Negli ultimi due decenni, gli AAS hanno attirato un grande interesse da parte degli scienziati come nuovi tensioattivi, non solo perché possono essere sintetizzati da risorse rinnovabili, ma anche perché gli AAS sono facilmente degradabili e hanno sottoprodotti innocui, rendendoli più sicuri per il ambiente.
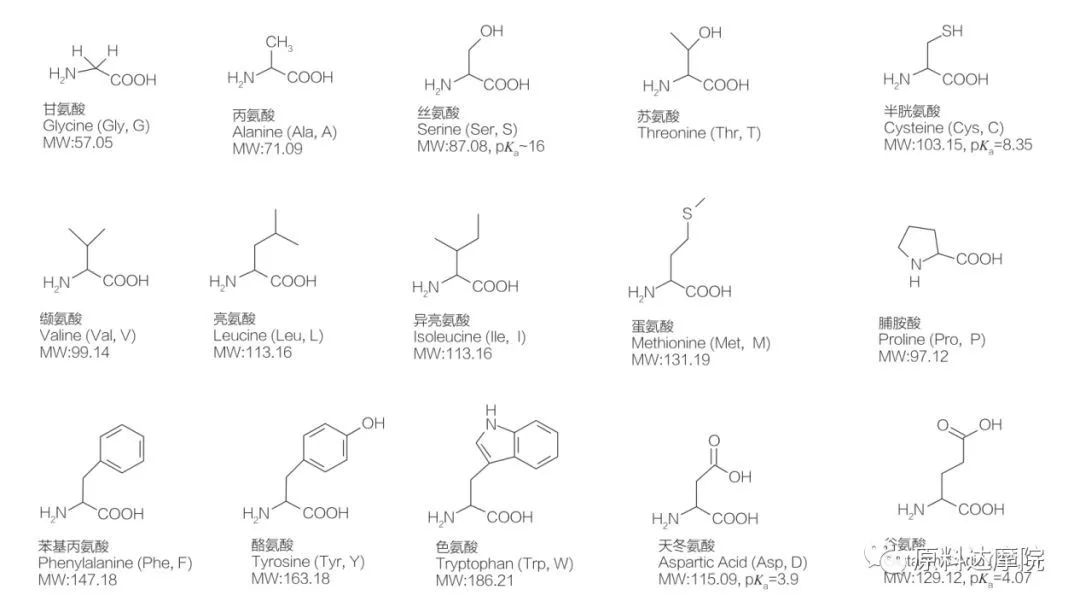
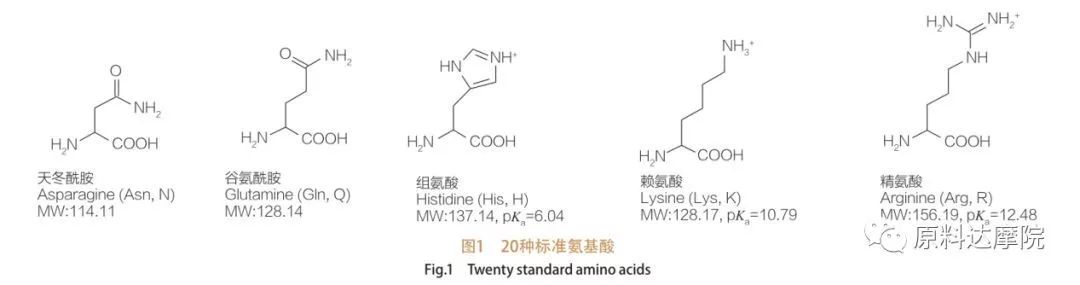
Gli AAS possono essere definiti come una classe di tensioattivi costituita da amminoacidi contenenti gruppi amminoacidici (HO 2 C-CHR-NH 2) o residui amminoacidici (HO 2 C-CHR-NH-).Le 2 regioni funzionali degli amminoacidi consentono la derivazione di un'ampia varietà di tensioattivi.È noto che in natura esistono un totale di 20 amminoacidi proteogeni standard, responsabili di tutte le reazioni fisiologiche durante la crescita e le attività della vita.Differiscono l'uno dall'altro solo in base al residuo R (Figura 1, pk a è il logaritmo negativo della costante di dissociazione acida della soluzione).Alcuni sono apolari e idrofobici, alcuni sono polari e idrofili, alcuni sono basici e altri sono acidi.
Poiché gli amminoacidi sono composti rinnovabili, anche i tensioattivi sintetizzati dagli amminoacidi hanno un alto potenziale per diventare sostenibili e rispettosi dell'ambiente.La struttura semplice e naturale, la bassa tossicità e la rapida biodegradabilità li rendono spesso superiori ai tensioattivi convenzionali.Utilizzando materie prime rinnovabili (ad es. amminoacidi e oli vegetali), gli AAS possono essere prodotti attraverso diverse vie biotecnologiche e chimiche.
All'inizio del XX secolo, si scoprì per la prima volta che gli aminoacidi venivano usati come substrati per la sintesi di tensioattivi.Gli AAS sono stati utilizzati principalmente come conservanti nelle formulazioni farmaceutiche e cosmetiche.Inoltre, gli AAS sono risultati biologicamente attivi contro una varietà di batteri, tumori e virus che causano malattie.Nel 1988, la disponibilità di AAS a basso costo ha generato l'interesse della ricerca per l'attività di superficie.Oggi, con lo sviluppo della biotecnologia, alcuni amminoacidi possono anche essere sintetizzati commercialmente su larga scala dal lievito, il che dimostra indirettamente che la produzione di AAS è più rispettosa dell'ambiente.
01 Sviluppo di amminoacidi
Già all'inizio del XIX secolo, quando furono scoperti per la prima volta gli amminoacidi presenti in natura, si prevedeva che le loro strutture fossero estremamente preziose, utilizzabili come materie prime per la preparazione di anfifili.Il primo studio sulla sintesi di AAS fu riportato da Bondi nel 1909.
In quello studio, N-acilglicina e N-acilalanina sono state introdotte come gruppi idrofili per i tensioattivi.Il lavoro successivo ha coinvolto la sintesi di lipoaminoacidi (AAS) utilizzando glicina e alanina, e Hentrich et al.pubblicato una serie di risultati,tra cui la prima domanda di brevetto, sull'uso di sali di acilsarcosinato e acilaspartato come tensioattivi nei prodotti per la pulizia della casa (es. shampoo, detergenti e dentifrici).Successivamente, molti ricercatori hanno studiato la sintesi e le proprietà fisico-chimiche degli amminoacidi acilici.Ad oggi, è stata pubblicata un'ampia letteratura sulla sintesi, le proprietà, le applicazioni industriali e la biodegradabilità degli AAS.
02 Proprietà strutturali
Le catene di acidi grassi idrofobici non polari di AAS possono variare in struttura, lunghezza e numero di catene.La diversità strutturale e l'elevata attività superficiale degli AAS spiegano la loro ampia diversità compositiva e le proprietà fisico-chimiche e biologiche.I gruppi di testa di AAS sono composti da amminoacidi o peptidi.Le differenze nei gruppi di testa determinano l'adsorbimento, l'aggregazione e l'attività biologica di questi tensioattivi.I gruppi funzionali nel gruppo di testa determinano quindi il tipo di AAS, inclusi cationico, anionico, non ionico e anfotero.La combinazione di amminoacidi idrofili e porzioni idrofobe a catena lunga forma una struttura anfifila che rende la molecola altamente tensioattiva.Inoltre, la presenza di atomi di carbonio asimmetrici nella molecola aiuta a formare molecole chirali.
03 Composizione chimica
Tutti i peptidi e i polipeptidi sono i prodotti di polimerizzazione di questi quasi 20 α-amminoacidi α-proteinogenici.Tutti i 20 α-amminoacidi contengono un gruppo funzionale acido carbossilico (-COOH) e un gruppo funzionale amminico (-NH 2), entrambi attaccati allo stesso atomo di carbonio α tetraedrico.Gli amminoacidi differiscono l'uno dall'altro per i diversi gruppi R attaccati al carbonio α (ad eccezione della licina, dove il gruppo R è l'idrogeno). I gruppi R possono differire per struttura, dimensione e carica (acidità, alcalinità).Queste differenze determinano anche la solubilità degli Aminoacidi in acqua.
Gli amminoacidi sono chirali (ad eccezione della glicina) e sono otticamente attivi per natura perché hanno quattro diversi sostituenti legati al carbonio alfa.Gli amminoacidi hanno due possibili conformazioni;sono immagini speculari non sovrapposte l'una dell'altra, nonostante il numero di L-stereoisomeri sia significativamente più alto.Il gruppo R presente in alcuni amminoacidi (fenilalanina, tirosina e triptofano) è arilico, portando ad un massimo assorbimento UV a 280 nm.L'α-COOH acido e l'α-NH2 basico negli amminoacidi sono in grado di ionizzare, ed entrambi gli stereoisomeri, qualunque essi siano, costruiscono l'equilibrio di ionizzazione mostrato sotto.
R-COOH ↔R-COO-+H+
R-NH3+↔R-NH2+H+
Come mostrato nell'equilibrio di ionizzazione sopra, gli amminoacidi contengono almeno due gruppi debolmente acidi;tuttavia, il gruppo carbossilico è molto più acido rispetto al gruppo amminico protonato.pH 7,4, il gruppo carbossilico è deprotonato mentre il gruppo amminico è protonato.Gli amminoacidi con gruppi R non ionizzabili sono elettricamente neutri a questo pH e formano zwitterione.
04 Classificazione
Gli AAS possono essere classificati in base a quattro criteri, descritti di seguito.
4.1 Secondo l'origine
| Secondo l'origine, AAS può essere suddiviso in 2 categorie come segue. ① Categoria naturale Alcuni composti presenti in natura contenenti amminoacidi hanno anche la capacità di ridurre la tensione superficiale/interfacciale e alcuni addirittura superano l'efficacia dei glicolipidi.Questi AAS sono noti anche come lipopeptidi.I lipopeptidi sono composti a basso peso molecolare, solitamente prodotti da Bacillus spp.
Tali AAS sono ulteriormente suddivisi in 3 sottoclassi:surfattina, iturina e fengicina.
|
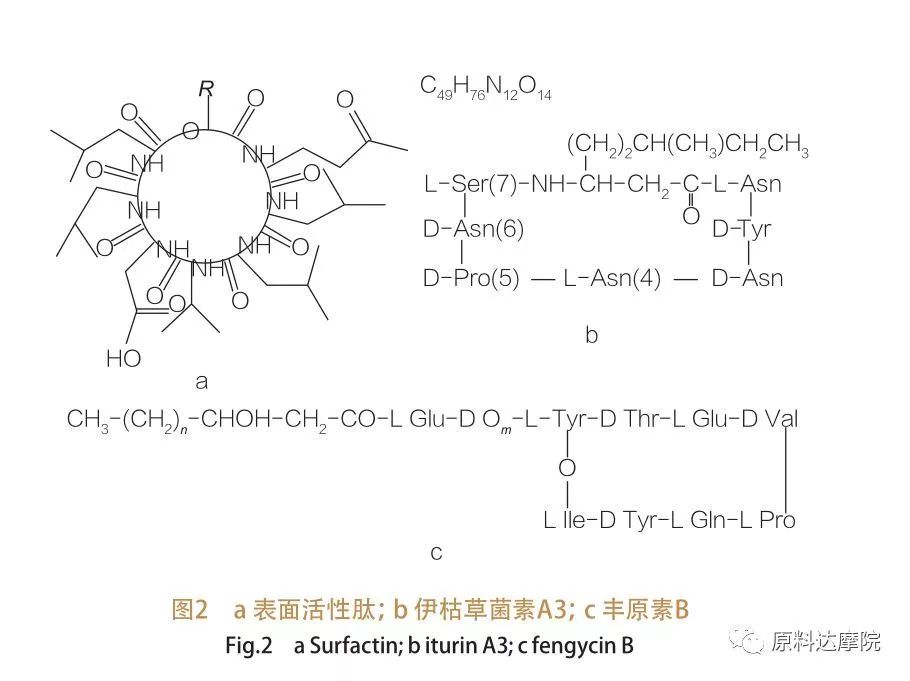
| La famiglia dei peptidi tensioattivi comprende varianti eptapeptidiche di una varietà di sostanze,come mostrato nella Figura 2a, in cui una catena di acido grasso β-idrossi insaturo C12-C16 è legata al peptide.Il peptide tensioattivo è un lattone macrociclico in cui l'anello è chiuso dalla catalisi tra il C-terminale dell'acido grasso β-idrossi e il peptide. Nella sottoclasse di iturin, ci sono sei varianti principali, vale a dire iturin A e C, micosubtilina e bacillomicina D, F e L.In tutti i casi, gli eptapeptidi sono legati alle catene C14-C17 dei β-amminoacidi grassi (le catene possono essere diverse).Nel caso delle ekurimicine, il gruppo amminico in posizione β può formare un legame ammidico con il C-terminale formando così una struttura lattame macrociclica.
La sottoclasse fengycin contiene fengycin A e B, che sono anche chiamati plipastatin quando Tyr9 è configurato D.Il decapeptide è legato a una catena di acidi grassi β-idrossi C14-C18 saturi o insaturi.Strutturalmente, la plipastatina è anche un lattone macrociclico, contenente una catena laterale Tyr in posizione 3 della sequenza peptidica e che forma un legame estere con il residuo C-terminale, formando così una struttura ad anello interno (come nel caso di molti lipopeptidi di Pseudomonas).
② Categoria sintetica L'AAS può anche essere sintetizzato utilizzando uno qualsiasi degli amminoacidi acidi, basici e neutri.Gli amminoacidi comuni utilizzati per la sintesi di AAS sono acido glutammico, serina, prolina, acido aspartico, glicina, arginina, alanina, leucina e idrolizzati proteici.Questa sottoclasse di tensioattivi può essere preparata con metodi chimici, enzimatici e chemoenzimatici;tuttavia, per la produzione di AAS, la sintesi chimica è economicamente più fattibile.Esempi comuni includono l'acido N-lauroil-L-glutammico e l'acido N-palmitoil-L-glutammico.
|
4.2 Basato su sostituenti della catena alifatica
Sulla base dei sostituenti della catena alifatica, i tensioattivi a base di amminoacidi possono essere suddivisi in 2 tipi.
Secondo la posizione del sostituente
| ① AAS N-sostituito Nei composti N-sostituiti, un gruppo amminico viene sostituito da un gruppo lipofilo o da un gruppo carbossilico, con conseguente perdita di basicità.l'esempio più semplice di AAS N-sostituito sono gli amminoacidi N-acilici, che sono essenzialmente tensioattivi anionici.Gli AAS n-sostituiti hanno un legame ammidico attaccato tra le porzioni idrofobe e idrofile.Il legame ammidico ha la capacità di formare un legame idrogeno, che facilita la degradazione di questo tensioattivo in ambiente acido, rendendolo così biodegradabile.
② AAS sostituito con C Nei composti C-sostituiti, la sostituzione avviene al gruppo carbossilico (tramite un legame ammidico o estere).Tipici composti C-sostituiti (per esempio esteri o ammidi) sono essenzialmente tensioattivi cationici.
③ AAS N- e C-sostituiti In questo tipo di tensioattivo, sia il gruppo amminico che quello carbossilico costituiscono la parte idrofila.Questo tipo è essenzialmente un tensioattivo anfotero. |
4.3 Secondo il numero di code idrofobiche
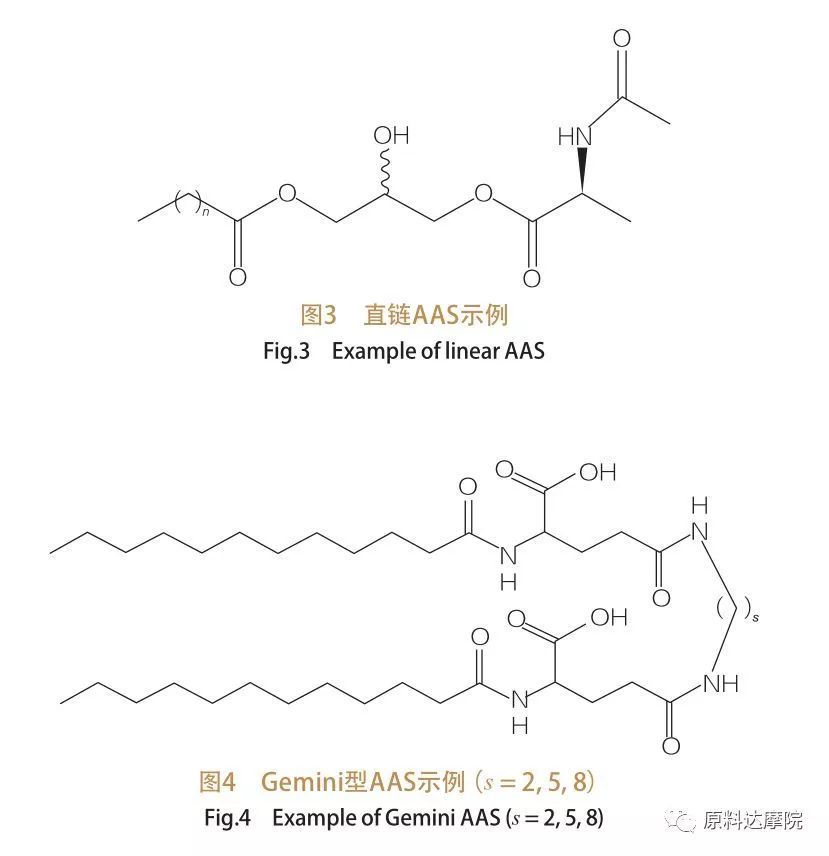
In base al numero di gruppi di testa e di code idrofobe, l'AAS può essere suddiviso in quattro gruppi.AAS a catena lineare, AAS di tipo Gemelli (dimero), AAS di tipo glicerolipidico e AAS di tipo anfifilico bicefalico (Bola).i tensioattivi a catena lineare sono tensioattivi costituiti da amminoacidi con una sola coda idrofobica (Figura 3).Gli AAS di tipo Gemini hanno due gruppi di teste polari di aminoacidi e due code idrofobiche per molecola (Figura 4).In questo tipo di struttura, i due AAS a catena lineare sono collegati tra loro da un distanziatore e sono quindi chiamati anche dimeri.Nel tipo glicerolipidico AAS, invece, le due code idrofobiche sono attaccate allo stesso gruppo di testa dell'amminoacido.Questi tensioattivi possono essere considerati analoghi di monogliceridi, digliceridi e fosfolipidi, mentre nell'AAS di tipo Bola, due gruppi di testa di amminoacidi sono collegati da una coda idrofobica.
4.4 In base al tipo di capogruppo
①AAS cationico
Il gruppo di testa di questo tipo di tensioattivo ha una carica positiva.Il primo AAS cationico è l'etil cocoil arginato, che è un pirrolidone carbossilato.Le proprietà uniche e diverse di questo tensioattivo lo rendono utile in disinfettanti, agenti antimicrobici, agenti antistatici, balsami per capelli, oltre ad essere delicato sugli occhi e sulla pelle e facilmente biodegradabile.Singare e Mhatre hanno sintetizzato AAS cationico a base di arginina e ne hanno valutato le proprietà fisico-chimiche.In questo studio, hanno affermato rese elevate dei prodotti ottenuti utilizzando le condizioni di reazione di Schotten-Baumann.Con l'aumento della lunghezza della catena alchilica e dell'idrofobicità, è stato riscontrato che l'attività superficiale del tensioattivo aumenta e la concentrazione micellare critica (cmc) diminuisce.Un altro è la proteina acilica quaternaria, che è comunemente usata come balsamo nei prodotti per la cura dei capelli.
②AAS anionico
Nei tensioattivi anionici, il gruppo di testa polare del tensioattivo ha una carica negativa.La sarcosina (CH 3 -NH-CH 2 -COOH, N-metilglicina), un amminoacido che si trova comunemente nei ricci di mare e nelle stelle marine, è chimicamente correlata alla glicina (NH 2 -CH 2 -COOH,), un amminoacido basico che si trova nelle cellule dei mammiferi.-COOH,) è chimicamente correlato alla glicina, che è un aminoacido basico presente nelle cellule dei mammiferi.L'acido laurico, l'acido tetradecanoico, l'acido oleico e i loro alogenuri ed esteri sono comunemente usati per sintetizzare i tensioattivi sarcosinati.I sarcosinati sono intrinsecamente delicati e sono quindi comunemente usati in collutori, shampoo, schiume da barba spray, creme solari, detergenti per la pelle e altri prodotti cosmetici.
Altri AAS anionici disponibili in commercio includono Amisoft CS-22 e AmiliteGCK-12, che sono nomi commerciali rispettivamente per sodio N-cocoil-L-glutammato e potassio N-cocoil glicinato.L'amilite è comunemente usata come agente schiumogeno, detergente, solubilizzante, emulsionante e disperdente e ha molte applicazioni nei cosmetici, come shampoo, saponi da bagno, bagnoschiuma, dentifrici, detergenti per il viso, saponi detergenti, detergenti per lenti a contatto e tensioattivi domestici.Amisoft è usato come detergente delicato per pelle e capelli, principalmente nei detergenti per viso e corpo, blocca i detergenti sintetici, i prodotti per la cura del corpo, gli shampoo e altri prodotti per la cura della pelle.
③zwitterionico o anfotero AAS
I tensioattivi anfoteri contengono siti sia acidi che basici e possono quindi cambiare la loro carica cambiando il valore del pH.In mezzi alcalini si comportano come tensioattivi anionici, mentre in ambienti acidi si comportano come tensioattivi cationici e in mezzi neutri come tensioattivi anfoteri.Lauril lisina (LL) e alcossi (2-idrossipropil) arginina sono gli unici tensioattivi anfoteri noti a base di amminoacidi.LL è un prodotto di condensazione di lisina e acido laurico.A causa della sua struttura anfotera, LL è insolubile in quasi tutti i tipi di solventi, ad eccezione di solventi molto alcalini o acidi.In quanto polvere organica, LL ha un'eccellente adesione alle superfici idrofile e un basso coefficiente di attrito, conferendo a questo tensioattivo un'eccellente capacità lubrificante.LL è ampiamente utilizzato nelle creme per la pelle e nei balsami per capelli ed è anche usato come lubrificante.
④AAS non ionico
I tensioattivi non ionici sono caratterizzati da gruppi di teste polari senza cariche formali.otto nuovi tensioattivi non ionici etossilati sono stati preparati da Al-Sabagh et al.da α-amminoacidi solubili in olio.In questo processo, la L-fenilalanina (LEP) e la L-leucina sono state prima esterificate con esadecanolo, seguita dall'amidazione con acido palmitico per dare due ammidi e due esteri di α-amminoacidi.Le ammidi e gli esteri sono stati quindi sottoposti a reazioni di condensazione con ossido di etilene per preparare tre derivati della fenilalanina con diversi numeri di unità poliossietileniche (40, 60 e 100).Si è scoperto che questi AAS non ionici hanno buone proprietà detergenti e schiumogene.
05 Sintesi
5.1 Via sintetica di base
In AAS, i gruppi idrofobici possono essere attaccati ai siti di ammine o acidi carbossilici o attraverso le catene laterali degli amminoacidi.Sulla base di ciò, sono disponibili quattro percorsi sintetici di base, come mostrato nella Figura 5.
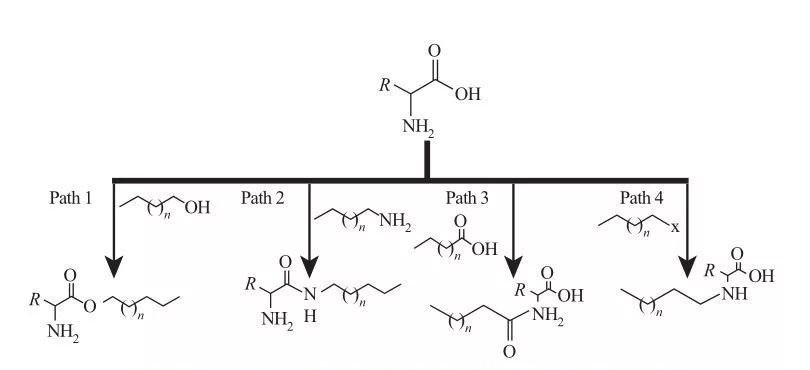
Fig.5 Percorsi fondamentali di sintesi di tensioattivi a base di aminoacidi
| Percorso 1. Le ammine estere anfifiliche sono prodotte mediante reazioni di esterificazione, nel qual caso la sintesi del tensioattivo viene solitamente ottenuta facendo rifluire alcoli grassi e amminoacidi in presenza di un agente disidratante e di un catalizzatore acido.In alcune reazioni, l'acido solforico funge sia da catalizzatore che da agente disidratante.
Percorso 2. Gli amminoacidi attivati reagiscono con le alchilammine per formare legami ammidici, con conseguente sintesi di amidoammine anfifiliche.
Percorso 3. Gli amidoacidi sono sintetizzati facendo reagire i gruppi amminici degli amminoacidi con gli amidoacidi.
Sentiero 4. Gli amminoacidi alchilici a catena lunga sono stati sintetizzati dalla reazione di gruppi amminici con aloalcani. |
5.2 Progressi nella sintesi e nella produzione
5.2.1 Sintesi di tensioattivi amminoacidici/peptidici a catena singola
Amminoacidi o peptidi N-acilici o O-acilici possono essere sintetizzati mediante acilazione catalizzata da enzimi di gruppi amminici o idrossilici con acidi grassi.Il primo rapporto sulla sintesi catalizzata da lipasi priva di solventi di amminoacidi ammidici o derivati di estere metilico utilizzava Candida antarctica, con rese che andavano dal 25% al 90% a seconda dell'amminoacido bersaglio.Il metiletilchetone è stato utilizzato anche come solvente in alcune reazioni.Vonderhagen et al.descrisse anche reazioni di N-acilazione catalizzate da lipasi e proteasi di amminoacidi, idrolizzati proteici e/o loro derivati utilizzando una miscela di acqua e solventi organici (ad es. dimetilformammide/acqua) e metil butilchetone.
All'inizio, il problema principale con la sintesi di AAS catalizzata da enzimi erano le basse rese.Secondo Valivety et al.la resa dei derivati dell'amminoacido N-tetradecanoil era solo del 2%-10% anche dopo l'utilizzo di diverse lipasi e l'incubazione a 70°C per molti giorni.Montet et al.ha anche incontrato problemi riguardanti la bassa resa di aminoacidi nella sintesi di N-acil lisina utilizzando acidi grassi e oli vegetali.Secondo loro, la resa massima del prodotto era del 19% in condizioni prive di solventi e utilizzando solventi organici.lo stesso problema è stato riscontrato da Valivety et al.nella sintesi di derivati N-Cbz-L-lisina o N-Cbz-lisina metil estere.
In questo studio, hanno affermato che la resa di 3-O-tetradecanoil-L-serina era dell'80% quando si utilizzava serina N-protetta come substrato e Novozyme 435 come catalizzatore in un ambiente privo di solventi fusi.Nagao e Kito hanno studiato l'O-acilazione di L-serina, L-omoserina, L-treonina e L-tirosina (LET) quando si utilizza la lipasi I risultati della reazione (la lipasi è stata ottenuta da Candida cylindracea e Rhizopus delemar in mezzo tampone acquoso) e ha riferito che le rese di acilazione di L-omoserina e L-serina erano piuttosto basse, mentre non si verificava alcuna acilazione di L-treonina e LET.
Molti ricercatori hanno sostenuto l'uso di substrati economici e prontamente disponibili per la sintesi di AAS economicamente vantaggiosi.Soo et al.ha affermato che la preparazione di tensioattivi a base di olio di palma funziona meglio con il lipoenzima immobilizzato.Hanno notato che la resa dei prodotti sarebbe migliore nonostante la reazione che richiede tempo (6 giorni).Gerova et al.ha studiato la sintesi e l'attività superficiale dell'N-palmitoil AAS chirale basato su metionina, prolina, leucina, treonina, fenilalanina e fenilglicina in una miscela ciclica/racemica.Pang e Chu hanno descritto la sintesi di monomeri a base di amminoacidi e monomeri a base di acido bicarbossilico in soluzione Una serie di esteri poliammidici a base di amminoacidi funzionali e biodegradabili sono stati sintetizzati mediante reazioni di co-condensazione in soluzione.
Cantaeuzene e Guerreiro hanno riportato l'esterificazione di gruppi di acido carbossilico di Boc-Ala-OH e Boc-Asp-OH con alcoli e dioli alifatici a catena lunga, con diclorometano come solvente e agarosio 4B (Sepharose 4B) come catalizzatore.In questo studio, la reazione di Boc-Ala-OH con alcoli grassi fino a 16 atomi di carbonio ha dato buone rese (51%), mentre per Boc-Asp-OH 6 e 12 atomi di carbonio erano migliori, con una corrispondente resa del 63% [64 ].99,9%) con rese comprese tra il 58% e il 76%, che sono state sintetizzate mediante la formazione di legami ammidici con varie alchilammine a catena lunga o legami estere con alcoli grassi mediante Cbz-Arg-OMe, dove la papaina ha agito da catalizzatore.
5.2.2 Sintesi di tensioattivi amminoacidi/peptidi a base di gemini
I tensioattivi gemini a base di amminoacidi sono costituiti da due molecole AAS a catena lineare collegate l'una all'altra da un gruppo distanziatore.Esistono 2 possibili schemi per la sintesi chemioenzimatica di tensioattivi a base di aminoacidi di tipo gemini (Figure 6 e 7).Nella Figura 6, 2 derivati di amminoacidi vengono fatti reagire con il composto come gruppo spaziatore e quindi vengono introdotti 2 gruppi idrofobici.Nella Figura 7, le 2 strutture a catena lineare sono direttamente collegate tra loro da un gruppo distanziatore bifunzionale.
Il primo sviluppo della sintesi catalizzata da enzimi di gemini lipoaminoacidi è stato introdotto da Valivety et al.Yoshimura et al.ha studiato la sintesi, l'adsorbimento e l'aggregazione di un tensioattivo gemini a base di amminoacidi a base di cistina e n-alchil bromuro.I tensioattivi sintetizzati sono stati confrontati con i corrispondenti tensioattivi monomerici.Faustino et al.ha descritto la sintesi di AAS monomerici a base di urea anionica basati su L-cistina, D-cistina, DL-cistina, L-cisteina, L-metionina e L-sulfoalanina e le loro coppie di gemelli mediante conduttività, tensione superficiale di equilibrio e stabilità loro caratterizzazione della fluorescenza di stato.È stato dimostrato che il valore cmc di gemini era inferiore confrontando monomero e gemini.
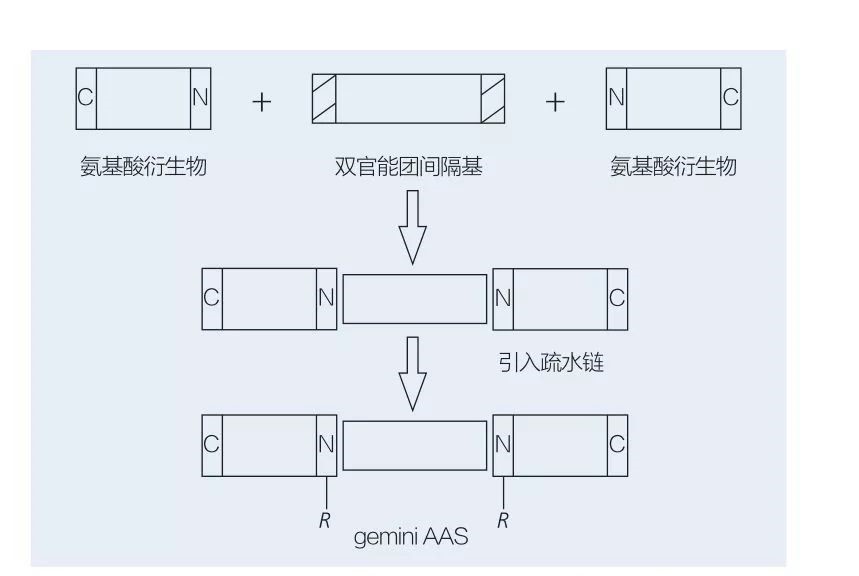
Fig.6 Sintesi di gemini AAS utilizzando derivati AA e spaziatore, seguita dall'inserimento del gruppo idrofobo
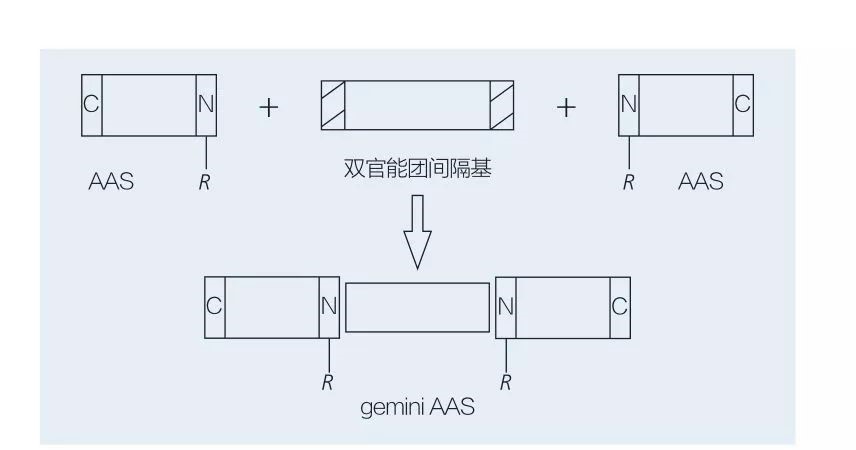
Fig.7 Sintesi di gemini AAS utilizzando spaziatore bifunzionale e AAS
5.2.3 Sintesi di tensioattivi aminoacidi/peptidi glicerolipidici
I tensioattivi amminoacidi/peptidi glicerolipidici sono una nuova classe di amminoacidi lipidici che sono analoghi strutturali di glicerolo mono- (o di-) esteri e fosfolipidi, a causa della loro struttura di una o due catene grasse con un amminoacido legato alla spina dorsale del glicerolo da un legame estere.La sintesi di questi tensioattivi inizia con la preparazione degli esteri del glicerolo degli amminoacidi a temperature elevate e in presenza di un catalizzatore acido (es. BF 3).Anche la sintesi catalizzata da enzimi (usando idrolasi, proteasi e lipasi come catalizzatori) è una buona opzione (Figura 8).
È stata segnalata la sintesi catalizzata da enzimi di coniugati di gliceridi di arginina dilaurylated utilizzando papaina.Sono state riportate anche la sintesi di coniugati di estere di diacilglicerolo dall'acetilarginina e la valutazione delle loro proprietà fisico-chimiche.
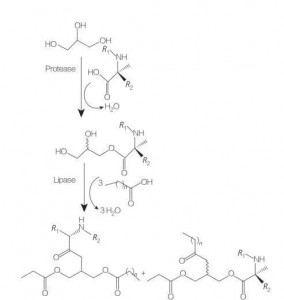
Fig.8 Sintesi di coniugati di amminoacidi mono e diacilglicerolici
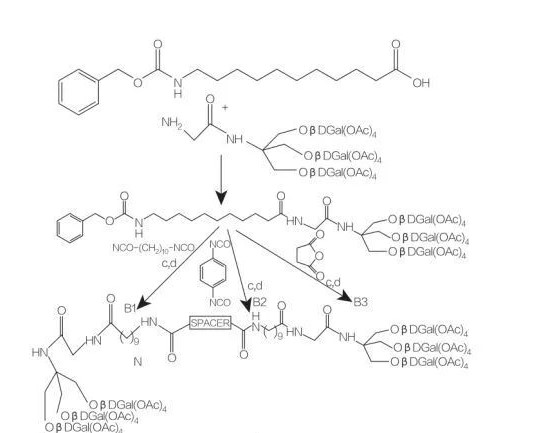
distanziatore: NH-(CH2)10-NH: composto B1
distanziatore: NH-C6H4-NH: composto B2
distanziatore: CH2-CH2: composto B3
Fig.9 Sintesi di anfifili simmetrici derivati da Tris(idrossimetil)amminometano
5.2.4 Sintesi di tensioattivi amminoacidici/peptidici a base di bola
Gli anfifili di tipo bola a base di aminoacidi contengono 2 aminoacidi che sono collegati alla stessa catena idrofobica.Francesco et al.descrisse la sintesi di anfifili di tipo bola con 2 amminoacidi (D- o L-alanina o L-istidina) e 1 catena alchilica di diverse lunghezze e ne studiò l'attività superficiale.Discutono la sintesi e l'aggregazione di nuovi anfifili di tipo bola con una frazione di amminoacidi (utilizzando un β-amminoacido non comune o un alcol) e un gruppo spaziatore C12-C20.I β-amminoacidi non comuni utilizzati possono essere un amminoacido zuccherino, un amminoacido derivato dall'azidotimina (AZT), un amminoacido norbornene e un amminoalcol derivato dall'AZT (Figura 9).la sintesi di anfifili simmetrici di tipo bola derivati dal tris(idrossimetil)amminometano (Tris) (Figura 9).
06 Proprietà fisico-chimiche
È ben noto che i tensioattivi a base di amminoacidi (AAS) sono diversi e versatili in natura e hanno una buona applicabilità in molte applicazioni come buona solubilizzazione, buone proprietà di emulsionamento, alta efficienza, elevate prestazioni di attività superficiale e buona resistenza all'acqua dura (ioni di calcio tolleranza).
Sulla base delle proprietà tensioattive degli amminoacidi (ad es. tensione superficiale, cmc, comportamento di fase e temperatura di Krafft), dopo studi approfonditi sono state raggiunte le seguenti conclusioni: l'attività superficiale dell'AAS è superiore a quella della sua controparte tensioattiva convenzionale.
6.1 Concentrazione micellare critica (cmc)
La concentrazione micellare critica è uno dei parametri importanti dei tensioattivi e governa molte proprietà tensioattive come la solubilizzazione, la lisi cellulare e la sua interazione con i biofilm, ecc. nel valore cmc della soluzione tensioattiva, aumentando così la sua attività superficiale.I tensioattivi a base di amminoacidi hanno solitamente valori di cmc inferiori rispetto ai tensioattivi convenzionali.
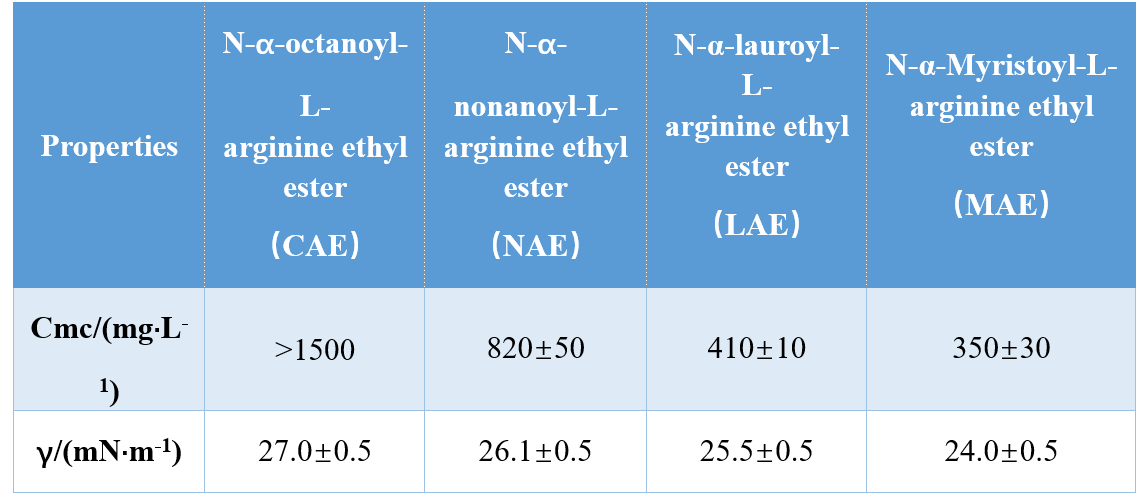
Attraverso diverse combinazioni di gruppi di testa e code idrofobe (ammide mono-cationica, ammide bi-cationica, estere a base di ammide bi-cationica), Infante et al.sintetizzato tre AAS a base di arginina e studiato i loro cmc e γcmc (tensione superficiale a cmc), dimostrando che i valori di cmc e γcmc diminuivano con l'aumentare della lunghezza della coda idrofobica.In un altro studio, Singare e Mhatre hanno scoperto che il cmc dei tensioattivi N-α-acilarginina diminuiva con l'aumentare del numero di atomi di carbonio della coda idrofobica (Tabella 1).
Yoshimura et al.ha studiato la cmc dei tensioattivi gemini a base di amminoacidi derivati dalla cisteina e ha mostrato che la cmc diminuiva quando la lunghezza della catena di carbonio nella catena idrofobica veniva aumentata da 10 a 12. L'ulteriore aumento della lunghezza della catena di carbonio a 14 comportava un aumento di cmc, che ha confermato che i tensioattivi gemini a catena lunga hanno una minore tendenza ad aggregarsi.
Faustino et al.riportato la formazione di micelle miste in soluzioni acquose di tensioattivi anionici gemini a base di cistina.I tensioattivi gemini sono stati anche confrontati con i corrispondenti tensioattivi monomerici convenzionali (C 8 Cys).I valori di cmc delle miscele di tensioattivi lipidici sono risultati inferiori a quelli dei tensioattivi puri.tensioattivi gemini e 1,2-diheptanoyl-sn-glyceryl-3-phosphocholine, un fosfolipide idrosolubile che forma micelle, avevano cmc a livello millimolare.
Shrestha e Aramaki hanno studiato la formazione di micelle viscoelastiche simili a vermi in soluzioni acquose di tensioattivi anionici-nonionici a base di aminoacidi misti in assenza di sali di miscela.In questo studio, è stato riscontrato che l'N-dodecil glutammato ha una temperatura di Krafft più elevata;tuttavia, quando neutralizzato con l'amminoacido basico L-lisina, ha generato micelle e la soluzione ha iniziato a comportarsi come un fluido newtoniano a 25 °C.
6.2 Buona solubilità in acqua
La buona solubilità in acqua dell'AAS è dovuta alla presenza di ulteriori legami CO-NH.Ciò rende gli AAS più biodegradabili e rispettosi dell'ambiente rispetto ai corrispondenti tensioattivi convenzionali.La solubilità in acqua dell'acido N-acil-L-glutammico è ancora migliore grazie ai suoi 2 gruppi carbossilici.Anche la solubilità in acqua di Cn(CA) 2 è buona perché ci sono 2 gruppi ionici di arginina in 1 molecola, il che si traduce in un assorbimento e una diffusione più efficaci all'interfaccia cellulare e persino un'efficace inibizione batterica a concentrazioni inferiori.
6.3 Temperatura di Krafft e punto di Krafft
La temperatura di Krafft può essere intesa come il comportamento di solubilità specifico dei tensioattivi la cui solubilità aumenta bruscamente al di sopra di una particolare temperatura.I tensioattivi ionici hanno la tendenza a generare idrati solidi, che possono precipitare fuori dall'acqua.Ad una particolare temperatura (la cosiddetta temperatura di Krafft) si osserva di solito un aumento drammatico e discontinuo della solubilità dei tensioattivi.Il punto di Krafft di un tensioattivo ionico è la sua temperatura di Krafft a cmc.
Questa caratteristica di solubilità è solitamente osservata per i tensioattivi ionici e può essere spiegata come segue: la solubilità del monomero privo di tensioattivi è limitata al di sotto della temperatura di Krafft fino al raggiungimento del punto di Krafft, dove la sua solubilità aumenta gradualmente a causa della formazione di micelle.Per garantire la completa solubilità, è necessario preparare formulazioni tensioattive a temperature superiori al punto di Krafft.
La temperatura di Krafft dell'AAS è stata studiata e confrontata con quella dei tensioattivi sintetici convenzionali. Shrestha e Aramaki hanno studiato la temperatura di Krafft dell'AAS a base di arginina e hanno scoperto che la concentrazione micellare critica mostrava un comportamento di aggregazione sotto forma di premicelle superiori a 2-5 ×10-6 mol-L -1 seguito dalla normale formazione di micelle ( Ohta et al. Hanno sintetizzato sei diversi tipi di N-esadecanoil AAS e hanno discusso la relazione tra la loro temperatura di Krafft e i residui di amminoacidi.
Negli esperimenti, è stato scoperto che la temperatura di Krafft dell'N-esadecanoil AAS aumentava con la diminuzione della dimensione dei residui amminoacidici (la fenilalanina è un'eccezione), mentre il calore di solubilità (assorbimento di calore) aumentava con la diminuzione della dimensione dei residui amminoacidici (con ad eccezione di glicina e fenilalanina).Si è concluso che in entrambi i sistemi di alanina e fenilalanina, l'interazione DL è più forte dell'interazione LL nella forma solida del sale N-esadecanoil AAS.
Brito et al.ha determinato la temperatura di Krafft di tre serie di nuovi tensioattivi a base di amminoacidi utilizzando la microcalorimetria a scansione differenziale e ha scoperto che la modifica dello ione trifluoroacetato in ione ioduro ha comportato un aumento significativo della temperatura di Krafft (circa 6 ° C), da 47 ° C a 53 ° C.La presenza di doppi legami cis e l'insaturazione presente nei derivati Ser a catena lunga ha portato a una significativa diminuzione della temperatura di Krafft.È stato riportato che il glutammato di n-dodecil ha una temperatura di Krafft più alta.Tuttavia, la neutralizzazione con l'amminoacido basico L-lisina ha portato alla formazione di micelle in soluzione che si comportavano come fluidi newtoniani a 25 °C.
6.4 Tensione superficiale
La tensione superficiale dei tensioattivi è correlata alla lunghezza della catena della parte idrofobica.Zhang et al.ha determinato la tensione superficiale del sodio coccoil glicinato con il metodo della piastra di Wilhelmy (25±0,2)°C e ha determinato il valore della tensione superficiale a cmc come 33 mN-m -1 , cmc come 0,21 mmol-L -1.Yoshimura et al.determinato la tensione superficiale della tensione superficiale a base di aminoacidi di tipo 2C n Cys di agenti tensioattivi a base di 2C n Cys.Si è riscontrato che la tensione superficiale a cmc diminuiva con l'aumentare della lunghezza della catena (fino a n = 8), mentre la tendenza era invertita per i tensioattivi con n = 12 o lunghezze di catena maggiori.
È stato anche studiato l'effetto del CaCl 2 sulla tensione superficiale di tensioattivi a base di amminoacidi bicarbossilati.In questi studi, CaCl 2 è stato aggiunto a soluzioni acquose di tre tensioattivi di tipo amminoacidico bicarbossilato (C12 MalNa 2, C12 AspNa 2 e C12 GluNa 2).I valori di plateau dopo cmc sono stati confrontati ed è stato trovato che la tensione superficiale diminuiva a concentrazioni molto basse di CaCl 2 .Ciò è dovuto all'effetto degli ioni calcio sulla disposizione del tensioattivo all'interfaccia gas-acqua.anche le tensioni superficiali dei sali di N-dodecilaminomalonato e N-dodecilaspartato erano pressoché costanti fino a 10 mmol-L -1 CaCl 2 di concentrazione.Al di sopra di 10 mmol-L -1, la tensione superficiale aumenta bruscamente, a causa della formazione di una precipitazione del sale di calcio del tensioattivo.Per il sale disodico dell'N-dodecil glutammato, una moderata aggiunta di CaCl 2 ha determinato una significativa diminuzione della tensione superficiale, mentre il continuo aumento della concentrazione di CaC1 2 non ha più causato cambiamenti significativi.
Per determinare la cinetica di adsorbimento dell'AAS di tipo gemini all'interfaccia gas-acqua, la tensione superficiale dinamica è stata determinata utilizzando il metodo della pressione massima delle bolle.I risultati hanno mostrato che per il tempo di prova più lungo, la tensione superficiale dinamica 2C 12 Cys non è cambiata.La diminuzione della tensione superficiale dinamica dipende solo dalla concentrazione, dalla lunghezza delle code idrofobiche e dal numero di code idrofobiche.L'aumento della concentrazione di tensioattivo, la diminuzione della lunghezza della catena e il numero di catene hanno determinato un decadimento più rapido.I risultati ottenuti per concentrazioni più elevate di C n Cys (n = da 8 a 12) sono risultati molto vicini al γ cmc misurato con il metodo Wilhelmy.
In un altro studio, le tensioni superficiali dinamiche di sodio dilauril cistina (SDLC) e sodio didecamino cistina sono state determinate mediante il metodo della piastra Wilhelmy e, inoltre, le tensioni superficiali di equilibrio delle loro soluzioni acquose sono state determinate mediante il metodo del volume di goccia.La reazione dei legami disolfuro è stata ulteriormente studiata anche con altri metodi.L'aggiunta di mercaptoetanolo alla soluzione 0,1 mmol-L -1SDLC ha portato a un rapido aumento della tensione superficiale da 34 mN-m -1 a 53 mN-m -1.Poiché NaClO può ossidare i legami disolfuro di SDLC a gruppi di acido solfonico, non sono stati osservati aggregati quando NaClO (5 mmol-L -1) è stato aggiunto alla soluzione SDLC 0,1 mmol-L -1.I risultati della microscopia elettronica a trasmissione e della diffusione dinamica della luce hanno mostrato che non si sono formati aggregati nella soluzione.È stato riscontrato che la tensione superficiale dell'SDLC aumentava da 34 mN-m -1 a 60 mN-m -1 in un periodo di 20 min.
6.5 Interazioni binarie di superficie
Nelle scienze della vita, numerosi gruppi hanno studiato le proprietà vibrazionali di miscele di AAS cationici (tensioattivi a base di diacilglicerolo arginina) e fosfolipidi all'interfaccia gas-acqua, concludendo infine che questa proprietà non ideale causa la prevalenza di interazioni elettrostatiche.
6.6 Proprietà di aggregazione
Lo scattering dinamico della luce è comunemente usato per determinare le proprietà di aggregazione di monomeri a base di amminoacidi e tensioattivi gemini a concentrazioni superiori a cmc, ottenendo un diametro idrodinamico apparente DH (= 2R H ).Gli aggregati formati da C n Cys e 2Cn Cys sono relativamente grandi e hanno un'ampia distribuzione su scala rispetto ad altri tensioattivi.Tutti i tensioattivi tranne 2C 12 Cys formano tipicamente aggregati di circa 10 nm.le dimensioni delle micelle dei tensioattivi gemini sono significativamente più grandi di quelle delle loro controparti monomeriche.Un aumento della lunghezza della catena di idrocarburi porta anche ad un aumento delle dimensioni delle micelle.Ohta et al.descritto le proprietà di aggregazione di tre diversi stereoisomeri di N-dodecil-fenil-alanil-fenil-alanina tetrametilammonio in soluzione acquosa e ha mostrato che i diastereoisomeri hanno la stessa concentrazione critica di aggregazione in soluzione acquosa.Iwahashi et al.indagato mediante dicroismo circolare, NMR e osmometria a tensione di vapore la formazione di aggregati chirali di acido N-dodecanoil-L-glutammico, N-dodecanoil-L-valina e loro esteri metilici in diversi solventi (come tetraidrofurano, acetonitrile, 1,4 -diossano e 1,2-dicloroetano) con proprietà rotazionali è stato studiato mediante dicroismo circolare, NMR e osmometria a pressione di vapore.
6.7 Adsorbimento interfacciale
Anche l'adsorbimento interfacciale di tensioattivi a base di amminoacidi e il suo confronto con la sua controparte convenzionale è una delle direzioni di ricerca.Ad esempio, sono state studiate le proprietà di adsorbimento interfacciale degli esteri dodecilici di amminoacidi aromatici ottenuti da LET e LEP.I risultati hanno mostrato che LET e LEP mostravano aree interfacciali inferiori rispettivamente all'interfaccia gas-liquido e all'interfaccia acqua/esano.
Bordes et al.ha studiato il comportamento della soluzione e l'adsorbimento all'interfaccia gas-acqua di tre tensioattivi di amminoacidi dicarbossilati, i sali disodici di dodecil glutammato, dodecil aspartato e aminomalonato (con 3, 2 e 1 atomi di carbonio tra i due gruppi carbossilici, rispettivamente).Secondo questo rapporto, il cmc dei tensioattivi dicarbossilati era 4-5 volte superiore a quello del sale di dodecilglicina monocarbossilato.Ciò è attribuito alla formazione di legami idrogeno tra i tensioattivi dicarbossilati e le molecole vicine attraverso i gruppi ammidici in essi contenuti.
6.8 Comportamento di fase
Si osservano fasi cubiche discontinue isotropiche per i tensioattivi a concentrazioni molto elevate.Le molecole tensioattive con gruppi di testa molto grandi tendono a formare aggregati di curvatura positiva più piccola.marchesi et al.ha studiato il comportamento di fase dei sistemi 12Lys12/12Ser e 8Lys8/16Ser (vedere Figura 10) e i risultati hanno mostrato che il sistema 12Lys12/12Ser ha una zona di separazione di fase tra le regioni della soluzione micellare e vescicolare, mentre il sistema 8Lys8/16Ser Il sistema 8Lys8/16Ser mostra una transizione continua (regione della fase micellare allungata tra la piccola regione della fase micellare e la regione della fase della vescicola).Va notato che per la regione delle vescicole del sistema 12Lys12/12Ser, le vescicole coesistono sempre con le micelle, mentre la regione delle vescicole del sistema 8Lys8/16Ser ha solo vescicole.
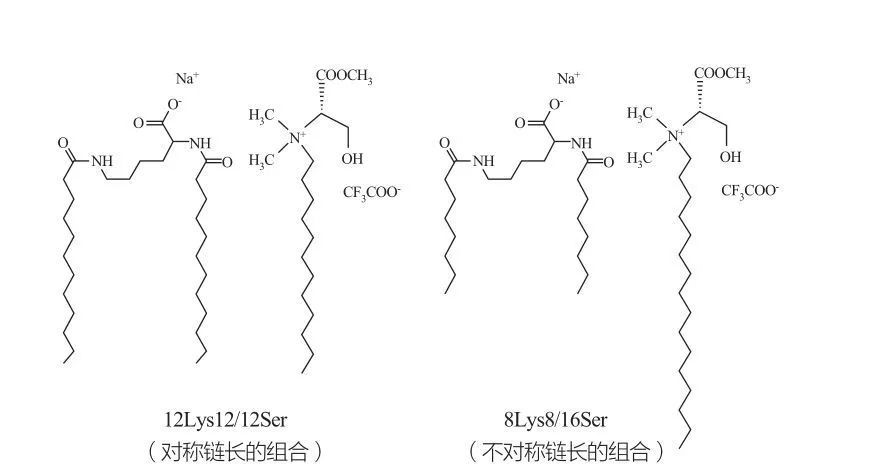
Miscele catanioniche dei tensioattivi a base di lisina e serina: coppia 12Lys12/12Ser simmetrica (a sinistra) e coppia 8Lys8/16Ser asimmetrica (a destra)
6.9 Capacità emulsionante
Kuchi et al.ha esaminato la capacità emulsionante, la tensione interfacciale, la disperdibilità e la viscosità di N-[3-dodecil-2-idrossipropil]-L-arginina, L-glutammato e altri AAS.Rispetto ai tensioattivi sintetici (le loro controparti non ioniche e anfotere convenzionali), i risultati hanno mostrato che gli AAS hanno una maggiore capacità emulsionante rispetto ai tensioattivi convenzionali.
Backo et al.ha sintetizzato nuovi tensioattivi amminoacidici anionici e ne ha studiato l'idoneità come solventi per spettroscopia NMR a orientamento chirale.Una serie di derivati anfifilici L-Phe o L-Ala a base di solfonato con diverse code idrofobiche (pentil~tetradecil) sono stati sintetizzati facendo reagire aminoacidi con anidride o-sulfobenzoica.Wu et al.sali di sodio sintetizzati di acile N-grasso AAS ehanno studiato la loro capacità di emulsionamento nelle emulsioni olio-in-acqua e i risultati hanno mostrato che questi tensioattivi si comportavano meglio con l'acetato di etile come fase oleosa che con l'n-esano come fase oleosa.
6.10 Progressi nella sintesi e nella produzione
La resistenza all'acqua dura può essere intesa come la capacità dei tensioattivi di resistere alla presenza di ioni come calcio e magnesio nell'acqua dura, cioè la capacità di evitare la precipitazione nei saponi di calcio.I tensioattivi con elevata resistenza all'acqua dura sono molto utili per formulazioni detergenti e prodotti per la cura personale.La resistenza all'acqua dura può essere valutata calcolando la variazione di solubilità e attività superficiale del tensioattivo in presenza di ioni calcio.
Un altro modo per valutare la resistenza all'acqua dura è calcolare la percentuale o i grammi di tensioattivo necessari per il sapone di calcio formato da 100 g di oleato di sodio da disperdere in acqua.Nelle aree con acqua molto dura, alte concentrazioni di ioni calcio e magnesio e contenuto di minerali possono rendere difficili alcune applicazioni pratiche.Spesso lo ione sodio viene utilizzato come controione di un tensioattivo anionico sintetico.Poiché lo ione calcio bivalente è legato a entrambe le molecole di tensioattivo, fa sì che il tensioattivo precipiti più facilmente dalla soluzione, rendendo meno probabile la detergenza.
Lo studio della resistenza all'acqua dura di AAS ha mostrato che la resistenza all'acqua dura e all'acido era fortemente influenzata da un gruppo carbossilico aggiuntivo, e la resistenza all'acqua dura e all'acido aumentava ulteriormente con l'aumento della lunghezza del gruppo spaziatore tra i due gruppi carbossilici .L'ordine di resistenza all'acido e all'acqua dura era C 12 glicinato < C 12 aspartato < C 12 glutammato.Confrontando rispettivamente il legame ammidico dicarbossilato e il tensioattivo amminico dicarbossilato, si è riscontrato che l'intervallo di pH di quest'ultimo era più ampio e la sua attività superficiale aumentava con l'aggiunta di una quantità appropriata di acido.Gli amminoacidi N-alchilici dicarbossilati hanno mostrato un effetto chelante in presenza di ioni calcio e l'aspartato C 12 ha formato un gel bianco.Il glutammato c 12 ha mostrato un'elevata attività superficiale ad alte concentrazioni di Ca 2+ e dovrebbe essere utilizzato nella desalinizzazione dell'acqua di mare.
6.11 Disperdibilità
La disperdibilità si riferisce alla capacità di un tensioattivo di prevenire la coalescenza e la sedimentazione del tensioattivo in soluzione.La disperdibilità è un'importante proprietà dei tensioattivi che li rende adatti all'uso in detergenti, cosmetici e prodotti farmaceutici.Un agente disperdente deve contenere un legame estereo, etereo, ammidico o amminico tra il gruppo idrofobo e il gruppo idrofilo terminale (o tra i gruppi idrofobi a catena lineare).
In generale, tensioattivi anionici come alcanolamido solfati e tensioattivi anfoteri come amidosulfobetaine sono particolarmente efficaci come agenti disperdenti per saponi di calcio.
Molti sforzi di ricerca hanno determinato la disperdibilità dell'AAS, dove la N-lauroil lisina è risultata scarsamente compatibile con l'acqua e difficile da usare per le formulazioni cosmetiche.In questa serie, gli amminoacidi basici N-acil-sostituiti hanno un'eccellente disperdibilità e sono utilizzati nell'industria cosmetica per migliorare le formulazioni.
07 Tossicità
I tensioattivi convenzionali, in particolare i tensioattivi cationici, sono altamente tossici per gli organismi acquatici.La loro tossicità acuta è dovuta al fenomeno dell'interazione adsorbimento-ione dei tensioattivi all'interfaccia cellula-acqua.La diminuzione della cmc dei tensioattivi di solito porta a un maggiore adsorbimento interfacciale dei tensioattivi, che di solito si traduce nella loro elevata tossicità acuta.Un aumento della lunghezza della catena idrofobica dei tensioattivi porta anche ad un aumento della tossicità acuta del tensioattivo.La maggior parte degli AAS è poco o non tossica per l'uomo e per l'ambiente (soprattutto per gli organismi marini) e può essere utilizzata come ingrediente alimentare, farmaceutico e cosmetico.Molti ricercatori hanno dimostrato che i tensioattivi aminoacidi sono delicati e non irritanti per la pelle.I tensioattivi a base di arginina sono noti per essere meno tossici delle loro controparti convenzionali.
Brito et al.ha studiato le proprietà fisico-chimiche e tossicologiche degli anfifili a base di amminoacidi e la loro [derivati da tirosina (Tyr), idrossiprolina (Hyp), serina (Ser) e lisina (Lys)] formazione spontanea di vescicole cationiche e ha fornito dati sulla loro tossicità acuta a Dafnia magna (IC 50).Hanno sintetizzato vescicole cationiche di bromuro di dodeciltrimetilammonio (DTAB)/Lys-derivati e/o miscele di Ser-/Lys-derivati e ne hanno testato l'ecotossicità e il potenziale emolitico, dimostrando che tutti gli AAS e le loro miscele contenenti vescicole erano meno tossici del tensioattivo convenzionale DTAB .
Rosa et al.ha studiato il legame (associazione) del DNA a vescicole cationiche stabili a base di amminoacidi.A differenza dei tensioattivi cationici convenzionali, che spesso sembrano essere tossici, l'interazione dei tensioattivi amminoacidici cationici sembra non essere tossica.L'AAS cationico si basa sull'arginina, che forma spontaneamente vescicole stabili in combinazione con alcuni tensioattivi anionici.Anche gli inibitori di corrosione a base di amminoacidi sono segnalati come non tossici.Questi tensioattivi sono facilmente sintetizzabili con elevata purezza (fino al 99%), basso costo, facilmente biodegradabili e completamente solubili in mezzi acquosi.Diversi studi hanno dimostrato che i tensioattivi amminoacidici contenenti zolfo sono superiori nell'inibizione della corrosione.
In un recente studio, Perinelli et al.riportato un profilo tossicologico soddisfacente dei ramnolipidi rispetto ai tensioattivi convenzionali.È noto che i ramnolipidi agiscono come potenziatori della permeabilità.Hanno anche riportato l'effetto dei ramnolipidi sulla permeabilità epiteliale dei farmaci macromolecolari.
08 Attività antimicrobica
L'attività antimicrobica dei tensioattivi può essere valutata dalla minima concentrazione inibente.L'attività antimicrobica dei tensioattivi a base di arginina è stata studiata in dettaglio.I batteri Gram-negativi sono risultati più resistenti ai tensioattivi a base di arginina rispetto ai batteri Gram-positivi.L'attività antimicrobica dei tensioattivi è solitamente aumentata dalla presenza di legami idrossilici, ciclopropanici o insaturi all'interno delle catene aciliche.Castillo et al.hanno dimostrato che la lunghezza delle catene aciliche e la carica positiva determinano il valore HLB (equilibrio idrofilo-lipofilo) della molecola, e questi hanno un effetto sulla loro capacità di rompere le membrane.L'estere metilico di Nα-acilarginina è un'altra importante classe di tensioattivi cationici con attività antimicrobica ad ampio spettro ed è facilmente biodegradabile e ha una tossicità bassa o nulla.Studi sull'interazione di tensioattivi a base di Nα-acilarginina metil estere con 1,2-dipalmitoil-sn-propiltriossil-3-fosforilcolina e 1,2-ditetradecanoil-sn-propiltriossil-3-fosforilcolina, membrane modello, e con organismi viventi in la presenza o l'assenza di barriere esterne hanno dimostrato che questa classe di tensioattivi ha una buona attività antimicrobica I risultati hanno mostrato che i tensioattivi hanno una buona attività antibatterica.
09 Proprietà reologiche
Le proprietà reologiche dei tensioattivi svolgono un ruolo molto importante nel determinare e prevedere le loro applicazioni in diversi settori, tra cui quello alimentare, farmaceutico, l'estrazione del petrolio, la cura personale e i prodotti per la cura della casa.Sono stati condotti molti studi per discutere la relazione tra viscoelasticità dei tensioattivi amminoacidici e cmc.
10 Applicazioni nell'industria cosmetica
Gli AAS sono utilizzati nella formulazione di molti prodotti per la cura personale.il potassio N-cocoil glicinato risulta essere delicato sulla pelle e viene utilizzato nella pulizia del viso per rimuovere fanghi e trucco.L'acido n-acil-L-glutammico ha due gruppi carbossilici, che lo rendono più solubile in acqua.Tra questi AAS, gli AAS a base di acidi grassi C 12 sono ampiamente utilizzati nella pulizia del viso per rimuovere morchie e trucco.Gli AAS con una catena C 18 sono usati come emulsionanti nei prodotti per la cura della pelle, e i sali di N-Lauryl alanina sono noti per creare schiume cremose che non sono irritanti per la pelle e possono quindi essere utilizzate nella formulazione di prodotti per la cura del bambino.Gli AAS a base di N-Lauryl utilizzati nei dentifrici hanno una buona detergenza simile al sapone e una forte efficacia di inibizione degli enzimi.
Negli ultimi decenni, la scelta dei tensioattivi per cosmetici, prodotti per la cura della persona e prodotti farmaceutici si è concentrata su bassa tossicità, dolcezza, delicatezza al tatto e sicurezza.I consumatori di questi prodotti sono profondamente consapevoli della potenziale irritazione, tossicità e fattori ambientali.
Oggi, gli AAS sono utilizzati per formulare molti shampoo, tinture per capelli e saponi da bagno grazie ai loro numerosi vantaggi rispetto alle loro controparti tradizionali nei cosmetici e nei prodotti per la cura personale.I tensioattivi a base di proteine hanno proprietà desiderabili necessarie per i prodotti per la cura personale.Alcuni AAS hanno capacità filmogene, mentre altri hanno buone capacità schiumogene.
Gli aminoacidi sono importanti fattori idratanti presenti in natura nello strato corneo.Quando le cellule epidermiche muoiono, diventano parte dello strato corneo e le proteine intracellulari vengono gradualmente degradate in amminoacidi.Questi amminoacidi vengono poi trasportati ulteriormente nello strato corneo, dove assorbono il grasso o sostanze simili al grasso nello strato corneo epidermico, migliorando così l'elasticità della superficie della pelle.Circa il 50% del fattore idratante naturale della pelle è composto da aminoacidi e pirrolidone.
Il collagene, comune ingrediente cosmetico, contiene anche aminoacidi che mantengono la pelle morbida.Problemi della pelle come rugosità e opacità sono dovuti in gran parte alla mancanza di aminoacidi.Uno studio ha dimostrato che la miscelazione di un amminoacido con un unguento ha alleviato le ustioni della pelle e le aree interessate sono tornate al loro stato normale senza diventare cicatrici cheloidi.
Gli amminoacidi si sono rivelati molto utili anche nella cura delle cuticole danneggiate.I capelli secchi e informi possono indicare una diminuzione della concentrazione di aminoacidi in uno strato corneo gravemente danneggiato.Gli amminoacidi hanno la capacità di penetrare la cuticola nel fusto del capello e assorbire l'umidità dalla pelle.Questa capacità dei tensioattivi a base di aminoacidi li rende molto utili in shampoo, tinture per capelli, ammorbidenti per capelli, balsami per capelli e la presenza di aminoacidi rende i capelli forti.
11 Applicazioni nella cosmesi quotidiana
Attualmente, c'è una crescente domanda di formulazioni detergenti a base di aminoacidi in tutto il mondo.È noto che gli AAS hanno una migliore capacità di pulizia, capacità schiumogena e proprietà ammorbidenti del tessuto, il che li rende adatti per detergenti domestici, shampoo, detergenti per il corpo e altre applicazioni.Si dice che un AAS anfotero derivato dall'acido aspartico sia un detergente altamente efficace con proprietà chelanti.È stato riscontrato che l'uso di ingredienti detergenti costituiti da acidi N-alchil-β-amminoetossi riduce l'irritazione cutanea.È stato segnalato che una formulazione detergente liquida costituita da N-coccoil-β-amminopropionato è un detergente efficace per le macchie di olio sulle superfici metalliche.Un tensioattivo acido amminocarbossilico, C 14 CHOHCH 2 NHCH 2 COONa, ha anche dimostrato di avere una migliore detergenza ed è utilizzato per pulire tessuti, tappeti, capelli, vetro, ecc. L'acido 2-idrossi-3-amminopropionico-N,N- È noto che il derivato dell'acido acetoacetico ha una buona capacità complessante e quindi conferisce stabilità agli agenti sbiancanti.
La preparazione di formulazioni detergenti a base di N-(N'-acil-β-alanil)-β-alanina a catena lunga è stata segnalata da Keigo e Tatsuya nel loro brevetto per una migliore capacità di lavaggio e stabilità, facilità di rottura della schiuma e buon ammorbidimento dei tessuti .Kao ha sviluppato una formulazione detergente a base di N-Acyl-1 -N-idrossi-β-alanina e ha riportato una bassa irritazione cutanea, un'elevata resistenza all'acqua e un elevato potere di rimozione delle macchie.
L'azienda giapponese Ajinomoto utilizza AAS a bassa tossicità e facilmente degradabili a base di acido L-glutammico, L-arginina e L-lisina come ingredienti principali in shampoo, detergenti e cosmetici (Figura 13).È stata segnalata anche la capacità degli additivi enzimatici nelle formulazioni detergenti di rimuovere le incrostazioni proteiche.N-acil AAS derivati da acido glutammico, alanina, metilglicina, serina e acido aspartico sono stati segnalati per il loro uso come eccellenti detergenti liquidi in soluzioni acquose.Questi tensioattivi non aumentano affatto la viscosità, anche a temperature molto basse, e possono essere facilmente trasferiti dal recipiente di stoccaggio del dispositivo di schiumatura per ottenere schiume omogenee.
Tempo di pubblicazione: giugno-09-2022

